2025年诺贝尔生理学或医学奖再次将目光投向了免疫调节领域,获奖成果揭示了调节性T细胞(Regulatory T cells, Treg)在自身免疫及炎症调控中的核心机制,调节性T细胞作为免疫系统的“刹车器”,再次受到科学界的重视。
Treg疗法临床管线
从临床转化来看,Treg在自身免疫、肿瘤免疫以及器官移植等方向进展较多。比如在自身免疫病治疗方面:针对Treg功能缺陷,通过IL-2信号通路激活或细胞移植恢复其活性,已在类风湿关节炎、1型糖尿病临床试验中显示疗效,在炎性驱动小儿自闭症疾病模型治疗等方面取得新进展。在癌症免疫疗法革新方面:肿瘤微环境中过度积累的Treg会抑制抗肿瘤免疫,通过CCR8单抗等药物靶向清除这类细胞可增强PD-1抑制剂疗效,相关联合疗法响应率及患者生存期获得提升。在器官移植排斥防护方面:输注体外扩增的Treg可降低肾移植等排斥反应风险。但是,人源Treg疗法目前尚未获得正式批准成为上市药物,还需要基础理论及临床医药实践的多方面突破[1]。
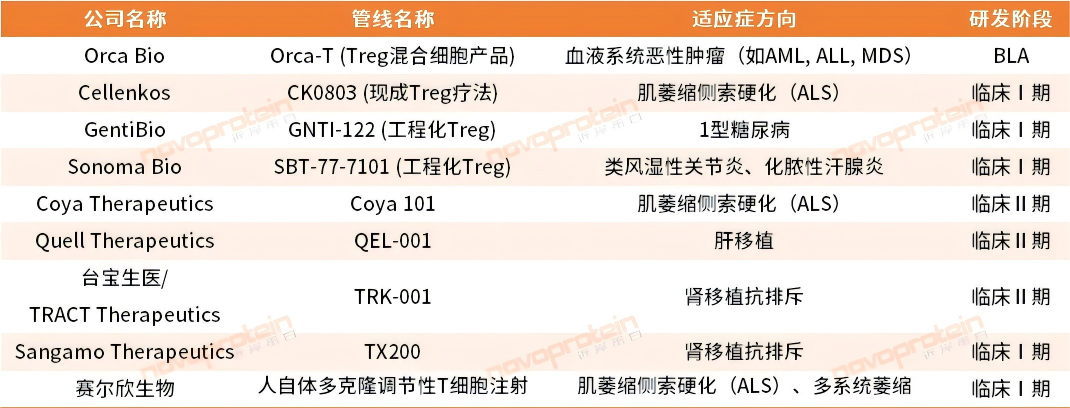
Novoprotein整理,如有错漏,欢迎指正
体外诱导Treg细胞关键因子
体外产生的Treg细胞被称为诱导性Treg细胞(iTreg),体内天然产生的Treg细胞被称为天然Treg细胞(nTreg)。
IL-2
通过结合CD4+T细胞表面受体IL-2R从而激活下游STAT5信号通路,STAT5激活后,促进Foxp3基因的转录,IL-2信号可以提高Foxp3表达的稳定性和量,防止其被下调或沉默,同时维持已分化Treg的抑制功能。
TGF-β1
Foxp3表达的关键启动因子也是诱导Foxp3表达的直接信号因子。体外诱导iTreg中在TGF-β和IL-2刺激下,初始T细胞即可产生Foxp3+Treg。
体外诱导Treg细胞实验流程[2]
PBMC分离
-
1 将抗凝全血与等体积PBS轻轻混匀,以便降低血液粘稠度。 -
2 在50mL离心管中加入密度离心介质(如Ficoll)溶液(体积建议为稀释血的1/2-1/3)。 -
3 倾斜离心管,缓慢地将稀释血液覆盖在密度离心介质上。 -
4 室温条件下,1150×g离心20 min。
注意:操作时应关闭离心刹车功能,将启动速度和停止速度降到最低
-
5 取出位于密度离心介质与血浆层之间的含有PBMCs的白色环,将其转移到一个新的50 mL离心管中。
注意:尽量减少吸取血浆和密度离心介质,不要触碰红色的红细胞沉淀。
-
6 用PBS补充至50 mL。在室温条件下,450×g离心10 min。
-
7 去除上清液,加入50mL RPMI培养基(含10%胎牛血清),并充分重悬。
注意:如果存在细胞团块,通过40 µm细胞滤网过滤细胞。
nTreg分离
-
1 配制分离缓冲液:在PBS中加入0.5%(w/v)人血清白蛋白和2 mM EDTA。
-
2 重悬并计数PBMCs,在室温条件下,450×g离心10 min。
-
3 每1×107个PBMCs加入90 µL分离缓冲液和2 µL CD25磁珠,充分重悬混匀后在4℃孵育15 min。
-
4 用PBS补充满至30 mL。在4℃以450×g离心10 min。
-
5 准备LS柱:用3 mL分离缓冲液平衡柱,丢弃流出液。
-
6 将细胞重悬于3 mL分离缓冲液中。将细胞转移到LS柱上,用新的15 mL离心管收集流出液。
-
7 用3 mL分离缓冲液洗柱2次,将收集的流出液储存在4℃以备后续步骤使用。
-
8 从磁铁上取下柱。每柱用3 mL分离缓冲液洗脱2次,收集至15 mL离心管中,得到CD25+的nTreg。
注意:如需要可过第二个柱,可进一步提高纯度。
-
9 在4℃以450×g离心10 min,丢弃上清。
-
10 用15 mL的T细胞培养基洗涤细胞,在4℃以450×g离心10 min,丢弃上清。
-
11 将细胞重悬于0.5 mL的T细胞培养基(含100 IU/mL的 IL-2)中。转移细胞至24孔板。再用0.5 mL培养基冲洗离心管,并合并至24孔板。
-
12 计数nTregs,用T细胞培养基(含100 IU/mL的IL-2)调整Treg密度至1-2×106 cells/mL。
注意:通常每个白细胞层的产率为1-4 x 106个Tregs。
-
13 在37℃、5%CO2条件下孵育nTreg直至使用。
CD4+T细胞分离
-
1 将nTreg耗竭的PBMCs合并至50 mL离心管中,用PBS补充满至50 mL。
注意:nTreg耗竭的PBMCs为【nTreg分离】中步骤8-9收集的流出液,用于进行CD4⁺T细胞分离。
-
2 在室温下以200×g离心PBMCs 5-10 min,去除上清。用50 mL PBS重悬细胞,重复2次。
注意:PBS洗涤对于去除血小板至关重要,后续负向分离试剂盒无法去除血小板。在此低速离心条件下,血小板会留在上清液中,可在显微镜载玻片上监测血小板去除情况。
-
3 用50 mL PBS重悬PBMCs,并进行细胞计数。
-
4 在4℃以450×g离心PBMCs 10 min,去除上清,每107个细胞加入40 µl分离缓冲液,重悬细胞。
-
5 每107个细胞加入10 µL初始CD4+T细胞生物素抗体混合物。混合后,在4℃孵育10 min。
-
6 加入40 mL冷PBS洗涤细胞,在4℃以450×g离心10 min。去除上清,每107个细胞加入80 µL分离缓冲液重悬细胞。
-
7 每107个细胞加入20 µL抗生物素微磁珠。充分混合,在4℃孵育15 min。
-
8 用冷PBS补充满至50 mL,在4℃以450×g离心10 min。
-
9 准备LS磁柱(用3mL 分离缓冲液进行平衡)。为避免磁柱过载,每个磁柱最多用于 2.5×108个PBMC。
-
10 去除上清,用3 mL分离缓冲液重悬细胞。将细胞转移至LS柱。收集流出液(含有初始CD4+T细胞),置于15 mL离心管中。
-
11 用2 mL分离缓冲液冲洗离心管,转移至柱上。
-
12 用3 mL分离缓冲液洗柱3次,每次等待柱停止滴液后再加入新的液体。
-
13 收集流出液(含初始CD4+T细胞),在4℃以450×g离心10 min。
-
14 去除上清后,用15 mL T细胞培养基洗涤细胞,在室温下以450×g离心10 min,去除上清/
注意:分离缓冲液含有EDTA,会螯合钙离子,从而影响T细胞激活。在进行任何刺激实验之前,需完全移除分离缓冲液,并用15 mL培养基洗涤细胞2次。
-
15 用T细胞培养基重悬细胞,调整密度至2-3×106cells/mL。在适当的培养瓶或孔板中于培养箱内过夜静置细胞。
iTreg细胞诱导培养
诱导培养基的准备
-
1 准备并预热T细胞培养基,需补充2 mM L-丙氨酰-L-谷氨酰胺。
-
2 准备细胞因子、激活抗体和化合物的储备浓度:
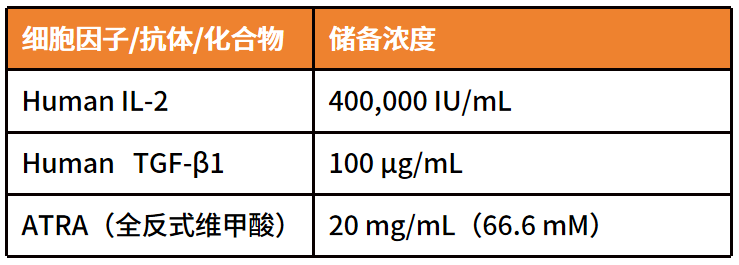
-
3 在T细胞培养基中配制4倍浓度的预混液(每孔50 µL)。
-
4 前一天,在96孔U型培养板中,每孔加入65 µl含5 µg/mL抗CD3抗体的PBS溶液。用铝箔包裹培养板,在4℃过夜孵育。
-
5 培养当天,移除孔中的抗CD3抗体溶液。每孔加入200 µL PBS,洗涤2次后备用。
-
6 往孔中加入50 µL的抗CD28抗体和IL-2预混液,50 µL 的TGF-β1预混液,50 µL的ATRA预混液。
-
7 用200 µl PBS填充所有空孔,包括边缘孔。将培养板在37℃、5%CO2条件下预热。
初始CD4+ T细胞接种培养
-
1 将细胞密度调整密度至2.2-2.6×106cells/mL。
-
2 将细胞加入准备好的刺激培养板,每孔50 µL细胞(110,000-130,000细胞/孔)。每个孔的总体积现应为200 µL。
-
3 将培养板放入37℃、5%CO2培养箱培养。
-
4 从第2至3天起,应可见增殖细胞的小簇,随着时间推移,这些小簇会聚集成更大的簇。
iTreg表型分析
qRT-PCR法
提取RNA对Foxp3和一个管家基因(如RPL13A)进行qRT-PCR。同时检测其他Treg标志基因的表达,例如“Treg上调基因”IL2RA、CTLA4、IKZF4,以及“Treg下调”基因IFNG、SATB1。
流式细胞术
通过流式细胞术筛选出CD4+CD25+Foxp3+Treg。
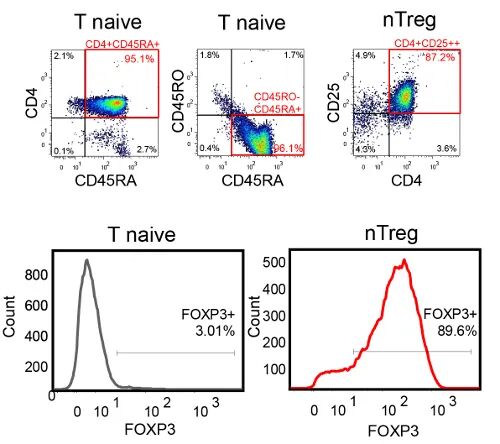
Treg细胞的流式表型[2]
Treg相关产品推荐
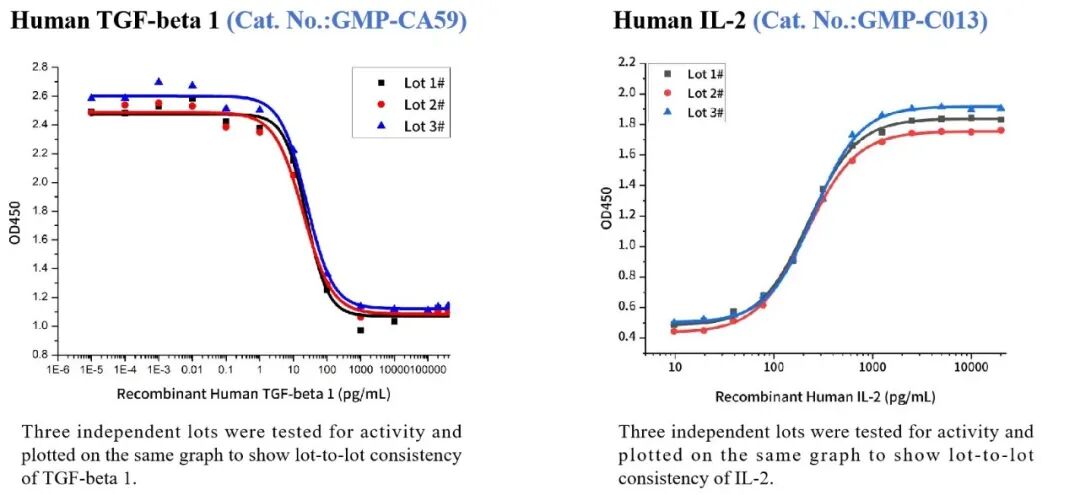
近岸蛋白提供T细胞体外激活培养以及Treg细胞分化的所需的抗体、人源和鼠源细胞因子,包括IL-2、TGF-β1、抗CD3抗体、抗CD28抗体等,并能提供批间稳定一致的GMP级产品,支持临床无缝过渡转化。
国际标准品测活
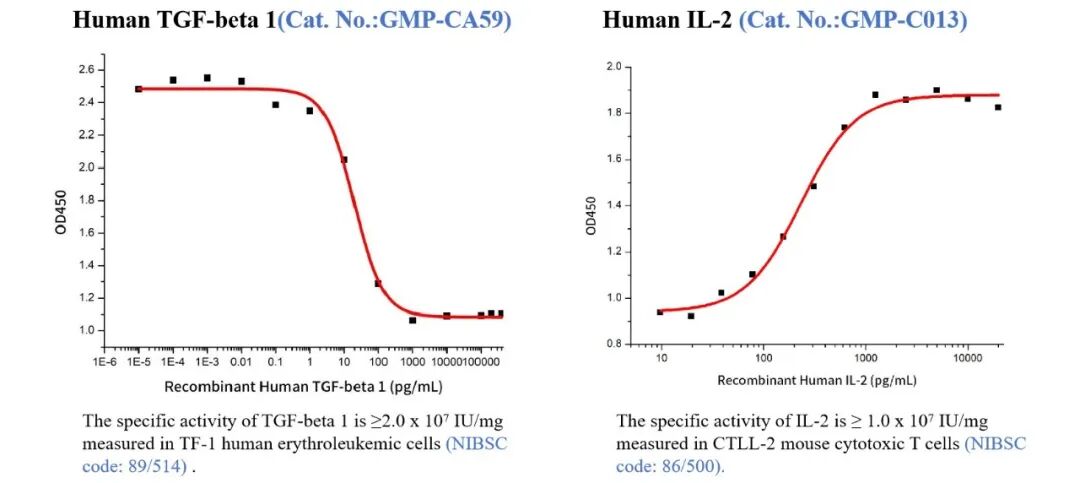
高批间一致性
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参考文献
[1]Xuemei Tong ,Bin Li From “Immune Homeostasis” to “Immune Perturbation”- Insights and Perspectives on the 2025 Nobel Prize in Physiology or Medicine[J].中国科学基金,2025,39(4)
